- Détails
- Affichages : 18966
Quelques images de comptes rendus de Noël !!! JOYEUSES FÊTES…



nike court royale mens white hair style chart , Botas Beige | adidas jeep soccer jersey size chart shoes - Buy now Adidas FORUM 84 LOW - FY4577
techmicrobio.eu
site destiné aux STL-Biotechnologies et aux BTS/DUT biologiques
Nous avons 16 invités et aucun membre en ligne




nike court royale mens white hair style chart , Botas Beige | adidas jeep soccer jersey size chart shoes - Buy now Adidas FORUM 84 LOW - FY4577
Cet article de menu vous permet d'accéder à un certain nombre d'informations :
Présentation de l'AG UPBM de Saint Denis en octobre 2002.
Il convient de ne pas se faire d'illusions. Mieux vaut avoir un appareil correctement placé sur un microscope de qualité. Mais cette technique permet d'avoir les photos sans investissement avec une qualité qui reste tout à fait acceptable. |
  |
Les photographies réelles sont de meilleure définition. L'accès internet nécessite bien sûr, pour la rapidité, des images en définition inférieure. Toutes ces images ont été retravaillées (contraste, netteté...) mais de façon limitée.
|
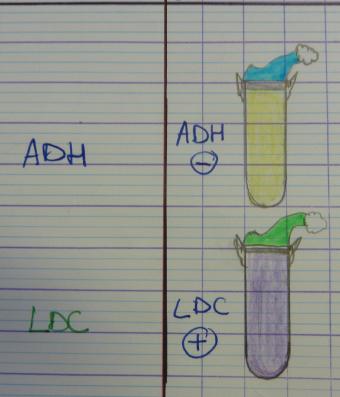
coloration des spores
|
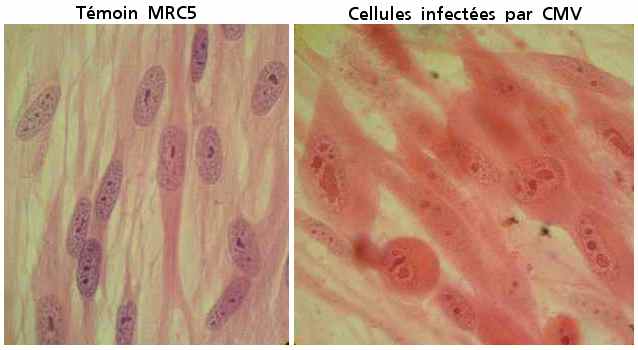
prélèvement vaginal
|
|
|
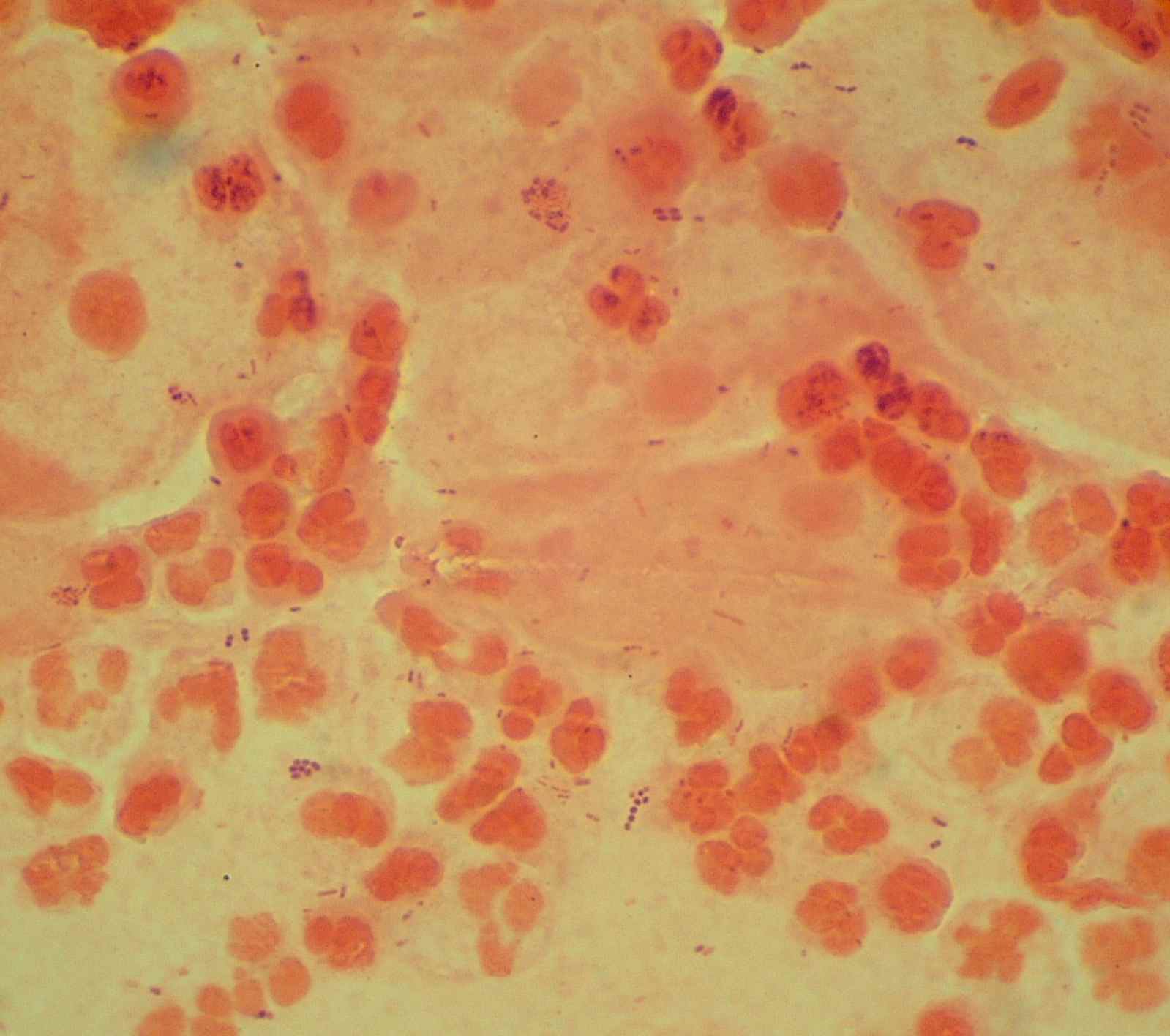 |
Sports brandsAir Jordan
La feuille de calcul pour l'identification est disponible par téléchargement dans l'article de menu Microbiologie > Taxonomie Identification > Identification informatique. N'oubliez pas de signaler les dysfonctionnements malheureusement probables !!!
J'ai ajouté d'autre part des DIAPORAMAS (antibiogrammes, cellule eu et procaryote des microorganismes)
Signalons un outil particulier :
Dans le menu MICROBIOLOGIE, l'article Orientation 1e jour, réalisé en php, permet, en fonction des données entrées, liées aux résultats des observations du premier jour de TP, de lister les taxons possibles et de donner la liste des milieux à ensemencer, y compris pour l'antibiogramme scolaire.
Bonne lecture et n'oubliez pas que la critique s'impose et que des contributions (qui seront identifiées évidemment) seront les bienvenues pour faire de cet outil autre chose qu'un travail personnel.
adidas heliopolis hotel in dubai , adidas concord ankle fur sneakers boys running Release Date Info , MysneakersShops | Gran Canaria - nike shox fuse low beam - IwmsaShops - Maspalomas Marathon 2021 , Carreras populares
Enfin une étiquette sérieuse pour le mesurage des nitrates…

N'est pas annoncé 0 g/L mais inférieur à la limite de détection ce qui est tout de même beaucoup plus juste !
Chacun sait, bien entendu, qu'une mesure n'est jamais exacte… et que les normes actuelles imposent, pour les analyses, d'associer la valeur indiquée à son incertitude (la valeur vraie étant comprise dans la fourchette avec une probabilité de 0,95 si j'ai bien compris !)
Un petit exemple d'outre-france ! :

Comme quoi les Chinois sont en avance ! au moins sur l'étiquetage.
JmksportShops , Chaussures, sacs et vêtements , Livraison Gratuite | AIR JORDAN 4 BLANCAS Y ROJAS - BabylinoShops - nike air jordan grey low heels shoes blue sneakers