VERSION NAZIA
| LOGO Lycée Paul Éluard 15 Avenue Jean Moulin 93206 SAINT DENIS | Procédure | Réf : 0001 | ||
| Galerie API20E | Dates | |||
| Rédacteur : MEHBOOB Nazia | Vérificateur | Approbateur : | ||
| Date : 2011_12_23 Signature : jnj | Date : Signature : | Date : Signature : | ||
1. Objet
La galerie API20E (bioMérieux) est une version miniaturisée des tests biochimiques classiques destinés à l'identification des Enterobacteriaceae (bactérie Gram négatif et anaérobies facultatives) .
2. Démarche
2.1. Matériel nécessaire
• Galerie API20E
• Pipette Pasteur
• Eau distillé 5 mL ou suspension médium
• Bec Hoffmann
• Les réactifs : chlorure de fer III (TDA),NaOH ou KOH (VP1) et Alpha-Naphtol (VP2), Acide sulfanilique et Naphtyl-1-Amine et si besoin poudre de Zinc (GLU), Réactif de Kovacs ou James (IND).
• Huile de vaseline
2.2. Manipulation
1.Préparation de l'inoculum
1-Prélever 1 colonie d'une souche pure
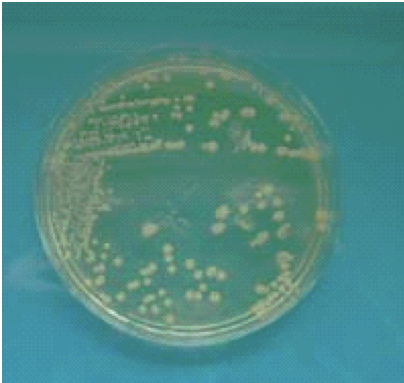
2- L'introduire dans 5mL d'eau distillée en réalisant une suspension d'opacité
0,5 Mac Farland
2.Ensemencement de la galerie
1.Ajouter de l'au distillé au fond de la boite en plastique pour réhydratés les différents tests.
2.Introduire la suspension bactérienne dans chaque tube à l'aide d'une pipette Pasteur stérile pointe appuyée à l’intérieur et sur le coté pour éviter la formation de bulles.
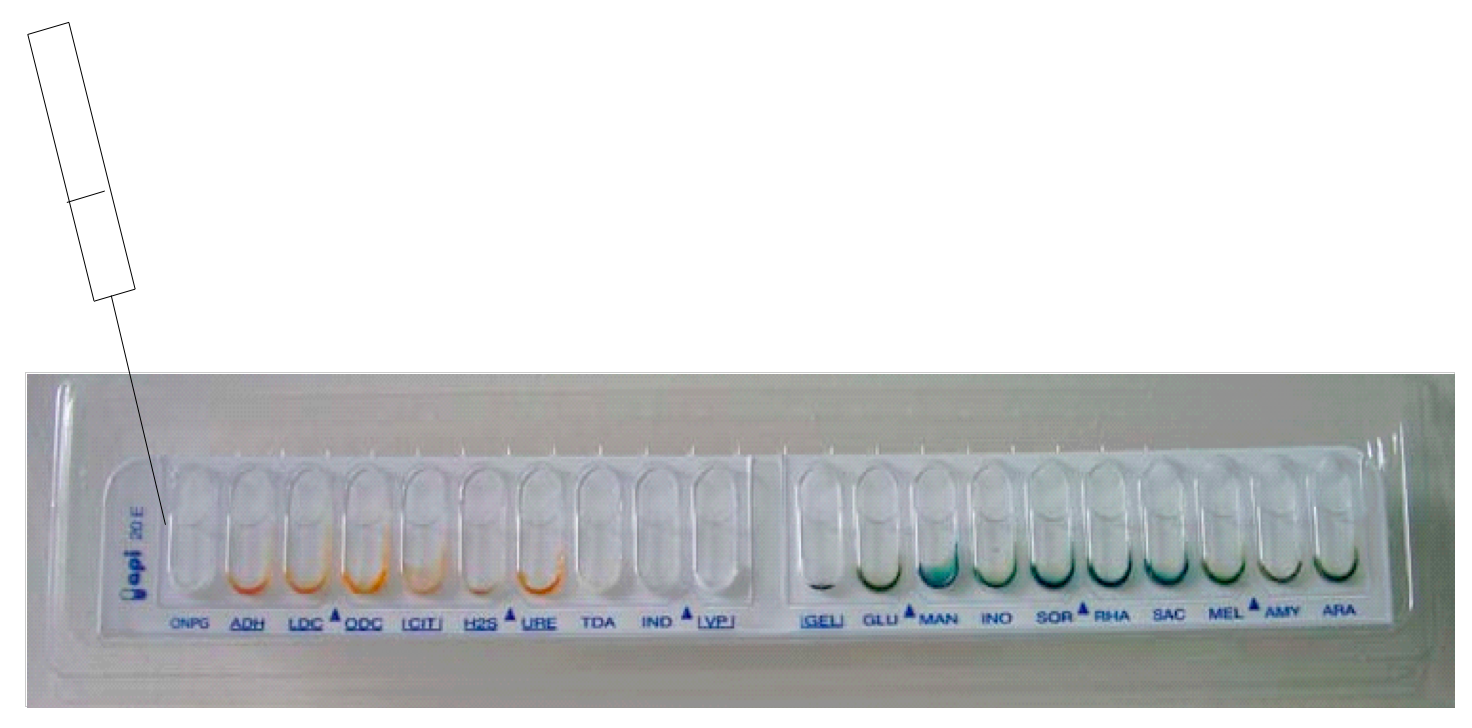
Pour les tests encadrés remplir le tube et la cupule (CIT,VP,GEL)
Pour les tests soulignés remplir la cupule et ajouter de l'huile de vaseline (ADH,LDC,ODC,H2S,URE)
Pour les tests ni encadrés ni soulignés remplir juste la cupule.
3.Incuber la galerie à 37° pendant 18 à 24h.
3.Lecture
• Pour la recherche de la TDA rajouter quelques gouttes de chlorure de fer III dans la cupule VP
• Pour la recherche de l'indole rajouter quelques gouttes de Kovacs ou James dans la cupule IND
• Pour la voie fermentative du butane-diol rajouter une goutte de réactif NaOH ou KOH puis une goutte de réactif Napht-1-ol dans la cupule VP. Attendre 10 minutes.
• Pour la recherche de la nitrate réductase rajouter une goutte d’acide sulfanilique puis une goutte de réactif
Naphtyl-1-amine. Si c’est incolore, ajouter de la poudre de Zinc dans la cupule GLU. Attendre 2 minutes.
4. Résultats
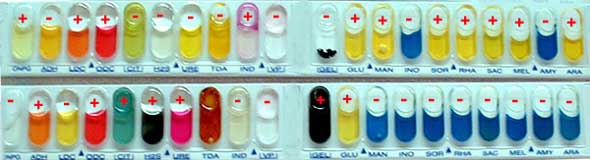
5. Identification de la souche
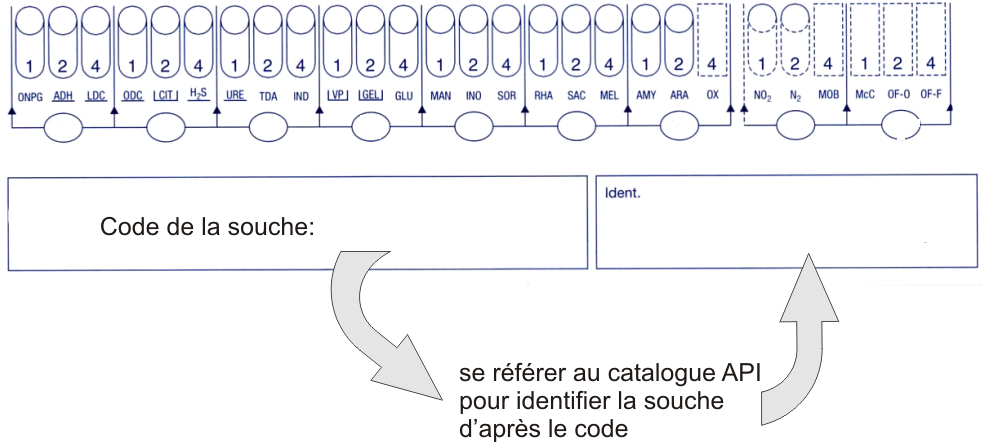
Les caractères successifs sont transformés dans un code en base 8 par triplets, en fonction de la position des caractères et de leur signe : tout caractère négatif vaut 0 point ; les caractères positifs en position 1 du triplet ont 1 point, en position 2 : 2 points et en position 3 : 4 points. Le résultat est reporté sur la fiche d’identification et il faut se référer au catalogue pour identifier la souche à l’aide du code.
| DATE : | Modifications apportées |
| 2009_04_08 | Création du texte |
|
|
|
Lycée Paul Éluard SAINT-DENIS
VERSION CAMILA
LOGO Lycée Paul Éluard | Procédure | Réf : M3001 | ||
Galerie API 20 E | Dates | |||
Rédacteur : Ziani Camila | Vérificateur | Approbateur : | ||
Date : 2011_11_28 | Date : | Date : | ||
1. Objet
Cette procédure est indispensable à l’orientation d’une entérobactérie. En effet, les entérobactéries sont identifiées essentiellement par des microméthodes, inventées avec la galerie API20 dans les années 1970 pour identifier de nombreuses entérobactéries pathogènes opportunistes.
2. Démarche
2.1. Matériaux utilisés :
- Galerie miniature API 20 E
- Pipette pasteur
- Bec Bunsen
- Huile de vaseline
- Eau distillée stérile (ou « Suspension Medium » 5 mL - Réf. bioMérieux 20 110).
- Réactifs : Chlorure de Fer III, Réactif de Kovacs (ou James), NaOH ou KOH (VP1), Napht-1-ol (VP2), Acide sulfanilique, Naphtyl-1-Amine et poudre de zinc si nécessaire.
ATTENTION : Il faut préalablement avoir développé une bactérie en colonies isolées dans une boîte de Pétri.
2.2. Manipulation :
Préparer une suspension bactérienne en prenant une seule colonie bien isolée sur un milieu gélosé pure et l’homogénéisé dans 5 mL d’eau distillée stérile afin d’avoir une opacité Mc Farland 0,5.

Humidifier le fond de la boîte en plastique en versant un peu d’eau par-dessus.
Casser le bout de la pipette Pasteur.
Placer la poire aspirante à l'autre extrémité de la pipette.
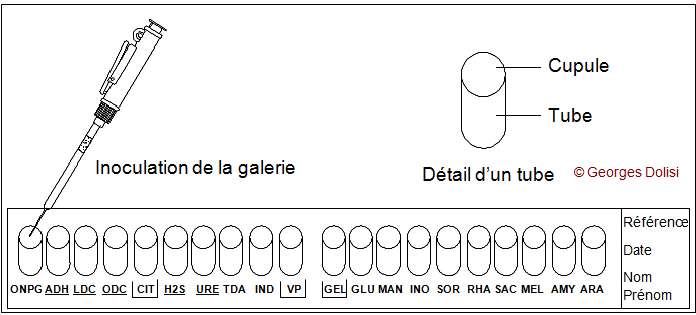
Aspirer de la suspension bactérienne.
Introduire la suspension bactérienne dans chaque tube à l’aide de la pipette Pasteur stérile ouverte pointe appuyée à l’intérieur et sur le côté pour éviter la formation de bulles. Pour les caractères encadrés, remplir de suspension le tube ET la cupule. Pour les caractères soulignés, remplir le tube de suspension puis recouvrir d’huile de vaseline. Pour tous les autres caractères, remplir simplement le tube de suspension.
Refermer la boîte d’incubation et la placer dans l’étuve à 35 - 37° C pendant 18 à 24 heures.
Après incubation :
- Pour la recherche de la TDA : introduire une goutte de chlorure de Fer III dans la cupule TDA.
Attendre 2 à 3 minutes.
- Pour la recherche de production d’indole : introduire une goutte de réactif de Kovacs dans la cupule IND.
- Pour la voie fermentative du butane-diol introduire une goutte de réactif NaOH ou KOH puis une goutte de réactif Napht-1-ol dans la cupule VP. Attendre 10 minutes.
- Pour la recherche de la nitrate réductase : introduire une goutte d’acide sulfanilique puis une goutte de réactif Naphtyl-1-amine. Si c’est incolore, ajouter de la poudre de Zinc. Attendre 2 minutes.
Lecture
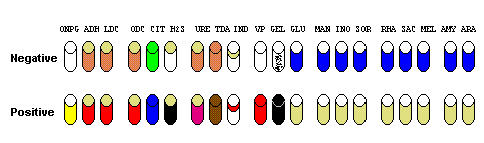
Identification de la souche :

Les caractères successifs sont transformés dans un code en base 8 par triplets, en fonction de la position des caractères et de leur signe : tout caractère négatif vaut 0 point ; les caractères positifs en position 1 du triplet ont 1 point, en position 2 : 2 points et en position 3 : 4 points. Le résultat est reporté sur la fiche d’identification et il faut se référer au catalogue pour identifier la souche à l’aide du code.
Historique des modifications de ce texte :
DATE : | Modifications apportées |
2011_11_28 | Création du texte |
|
|
Lycée Paul Éluard SAINT-DENIS

