| Lycée Paul Éluard 15 Avenue Jean Moulin 93206 SAINT DENIS | PROCÉDURE | Réf : M6002 |
| Réalisation d’un antibiogramme en boite (disque) | Dates | |
| Rédacteur : Montagne Théo | Vérificateur | Approbateur : |
| Date : 21/12/2011 Signature : Montagne Théo | Date : Signature : | Date : Signature : |
1. OBJET
Il s’agit d’une technique de laboratoire visant à tester la sensibilité d'une souche bactérienne vis-à-vis d'un ou plusieurs antibiotiques supposés ou connus.
2. DÉMARCHE
Matériel:
- disques d'antibiotique, ou un distributeur permettant la dépose standardisée des disques sur la gélose.
- une souche pure de la bactérie à étudier
- un râteau ou un écouvillon
- une pipette de 1 mL
- tube à hémolyse
- pipette pasteur
- étalon de Mac Farland n°0.5 (1.5*10? UFC/mL)
- eau physiologique stérile
Milieu de culture:
une gélose Mueller-Hinton en boîte de Pétri
Technique:
-
Réalisation de l’inoculum
À partir de l’isolement , réaliser une suspension microbienne équivalente à celle d’un bouillon de 18h, soit de Mac ferland 0,5.
Diluer la suspension en fonction du groupe bacterien.
-
L’ensemencement
Deux techniques peuvent être utilisées : inondation par la suspension préparée ou étalement à l’aide d’un écouvillon trempé dans la suspension :
Technique par innondation
Innonder la boite avec 3 à 5 ml de suspension prélevé à la pipette.
Réaspirer soigneusement à la pipette l’excès de suspension.
Secher les boites.
Technique par écouvillonnage
Tremper l’écouvillon dans la suspension et l’essorer sur les bord.
Ensemencer la boite en frottant l’écouvillon sur la gélose.
-
Application des disques
Déposer les disques choisis en les espaçant de 3 cm
Lecture:
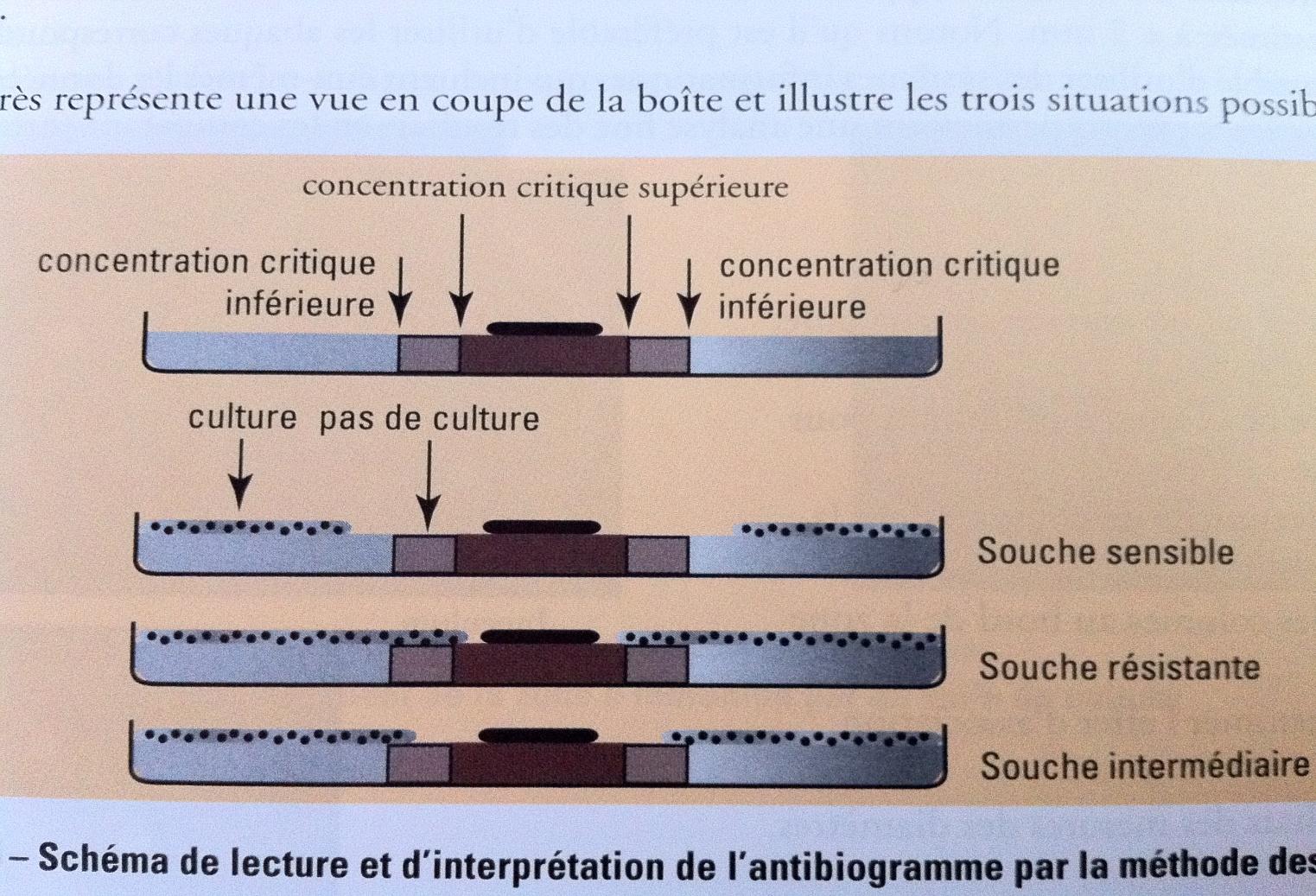
Mesuer du diamètre d’inhibition autour de chaque disque d’antibiotique permetant ainsi l’estimation de la CMI. On peut aussi associer les diamètre critique corespondant à deux concentrations critiques (concentration critique superieur et inferieur). La comparaison de la CMI aux deux concentrationscritiques permet de determiner le caractère sensible, intermediaire ou résistante de la souche :
-Diamètre d’inhibition < diamètre de la concentration critique superieur = sensible
- Diamètre d’inhibition > diamètre de la concentration critique inferieur = résistante
- Diamètre d’inhibition compris entre les deux concentrations critiques = intermédiaire
3. BIBLIOGRAPHIE
Dictionnaire des techniques
Wikipédia
http://www.techno-science.net/?onglet=glossaire&definition=1002
Lycée Paul Éluard | PROCÉDURE | RÉF : type-numéro à mettre | ||
Réalisation d'un antibiogramme en boîte | Création date | |||
Rédactrice : USLU Sule | Vérificateur : | Approbatrices : | ||
Date : 2010_03_30 | Date : Visa | Date : Visa | ||
1. OBJET
Un antibiogramme est une technique de laboratoire visant à tester la sensibilité d'une souche bactérienne vis-à-vis d'un ou plusieurs antibiotiques supposés ou connus.Le principe consiste à placer la culture de bactéries en présence du ou des antibiotiques et à observer les conséquences sur le développement et la survie de celle-ci. On peut par exemple placer plusieurs pastilles imbibées d'antibiotiques sur une souche bactérienne déposée dans une boîte de Petri. Il existe trois types d'interprétation selon le diamètre du cercle qui entoure le disque d'antibiotique : souche ou bactérie sensible, intermédiaire ou résistante.
2. DÉMARCHE
Matériel
- une gélose Mueller-Hinton en boîte de Petri
- disques d'antibiotique, ou un distributeur permettant la dépose standardisée des disques sur la gélose.
- une souche pure de la bactérie à étudier
- un râteau ou un écouvillon
- une pipette de 1 mL
- tube à hémolyse
- pipette pasteur
- étalon de Mac Farland no 0.5 (1.5*10⁸ UFC/mL)
- Eau physiologique stérile
Réalisation d'une suspension
Vous disposez de colonies pures sur un milieu de culture, dans ce cas :
- mettre stérilement de l'eau physiologique dans un tube à hémolyse ;
- prélever les colonies pures et les mettre en suspension jusqu'à obtenir la même opacité que l'étalon Mac Farland 0.5 ;
- si la suspension est trop trouble, ajuster l'opacité en ajoutant de l'eau physiologique.
Préparation de la gélose
- Prendre la gélose de Mueller-Hinton, vérifier l'absence d'eau à la surface ; s'il y en a, laisser sécher ;
- annoter où seront positionnés les disques d'antibiotiques sur le fond de la boîte (Il faut les éloigner de 1 cm du bord minimum) ;
- (conseil : diviser la boîte autant de fois (maximum 5 pour une boîte de 10 cm, ou 12 pour une boîte de 15 cm) que vous avez d'antibiotiques, ou utiliser un patron) ;
- ensemencer la gélose par 1 mL de suspension ;
- étaler le volume avec le râteau du centre vers les bords ;
- ou tremper l'écouvillon dans la suspension, enlever l'excès d'inoculum par pression sur les bords du tube, écouvillonner régulièrement la gélose en tournant la plaque de 60 ° jusqu'à ensemencement de la totalité de la surface ;
- laisser sécher de 3 à 5 minutes ;
- déposer les disques d'antibiotiques ;
- incuber 16 à 18 h, à 35 °C (au maximum 24 h).
Lecture des résultats
- Mesurer les diamètres des auréoles (zones d'inhibition de croissance de la souche microbienne).
Pour chaque souche microbienne, la sensibilité ou la résistance à un antibiotique est différente. Elle fait appel
aux notions de concentration critique inférieure (c) et de concentration critique supérieure (C).
- c : dose minimale d'antibiotique qu'un malade peut recevoir sans dangers et qui fait effet sur la souche bactérienne.
- C : dose maximale d'antibiotique qu'un malade peut recevoir sans dangers et qui fait effet sur la souche bactérienne.
Pharmacocinétique : chez quelqu'un correctement traité par un antibiotique, la concentration d'antibiotique dans l'organisme est supposée osciller entre la concentration critique inférieure et supérieure.
Ces données sont disponibles sur des abaques.
Pour chaque couple bactérie-antibiotique, on détermine une concentration minima inhibitrice (ou concentration minimale inhibitrice, ou CMI). La CMI est la plus petite concentration d'antibiotique qui inhibe toute croissance visible. En comparant la CMI aux concentrations critiques, on détermine la sensibilité ou la résistance de la bactérie à l'antibiotique.
- La bactérie est sensible à l'antibiotique quand la CMI est inférieure à la concentration critique inférieure. Concrètement, ceci signifie qu'il suffit d'une faible concentration d'antibiotique pour tuer les bactéries et que cette dose nécessaire est encore plus faible que la plus faible des doses qu'on peut administrer chez l'homme. Donc en clair, si on traite quelqu'un avec l'antibiotique, la concentration de celui-ci dans l'organisme sera toujours suffisante pour tuer les bactéries.
- La bactérie est résistante à l'antibiotique quand la CMI est supérieure à la concentration critique supérieure. Concrètement, la dose nécessaire pour tuer les bactéries est bien trop élevée pour être supportée chez l'homme sans effets secondaires importants. Cet antibiotique ne peut pas être utilisé pour traiter une infection.
- La bactérie est intermédiaire à l'antibiotique quand la CMI est comprise entre les deux concentrations critiques. En pratique, ça correspond à une situation où la concentration est tantôt suffisante pour tuer les bactéries, tantôt insuffisante. Il faut considérer que la bactérie sera résistante in vivo et il ne faut pas utiliser cet antibiotique.
3. BIBLIOGRAPHIE
Site web : www.wikipedia.orghttp://fr.wikipedia.org/wiki/Antibiogramme
http://www.geniebio.ac-aix-marseille.fr/biospip/spip.php?article253&id_document=856
pages.usherbrooke.ca/.../techniques_microbio.htm
4. HISTORIQUE
(indiquer dans le tableau les modifications réalisées. Mettre les éléments avec le dernier en HAUT. Respectez le format de date : ANNEE_MOIS_JOUR)
| DATES | |
| 2010_03_30 | Création par : USLU Sule |

